2020/2021 لا جمهورية الجزائرية الديمقراطية الشعبية République Algérienne Démocr
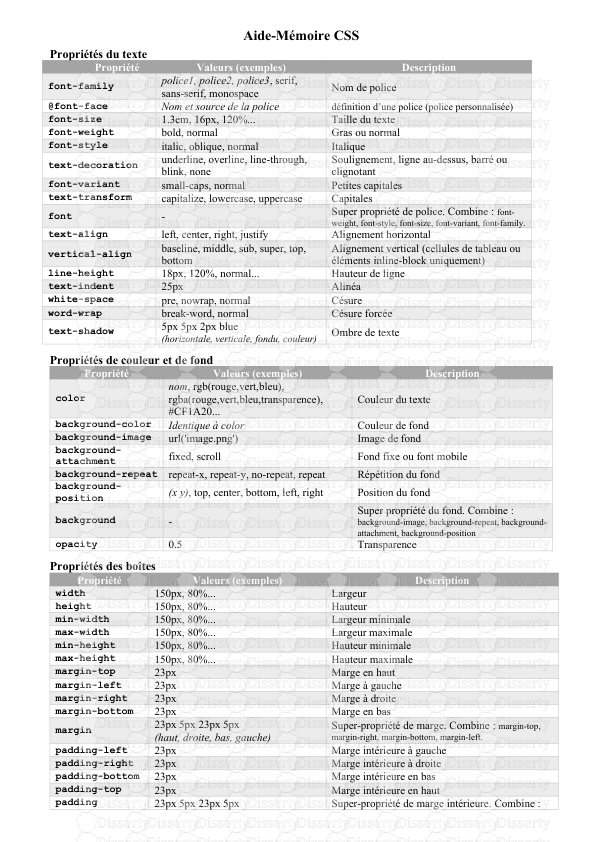
2020/2021 لا جمهورية الجزائرية الديمقراطية الشعبية République Algérienne Démocratique et Populaire وزارة التعليم العالي والبحث العلمي Ministère de l'Enseignement Supérieur et de la Recherche Scientifique Faculté de Médecine Département de Pharmacie Chimie Minérale Pharmaceutique PLAN : I. INTRODUCTION II. HISTORIQUE III. ETAT NATUREL : IV. PREPARATION V. PROPRIETES PHYSIQUES : VI. PROPRIETES CHIMIQUES : VII. LES HYDRURES VIII. USAGES MONOGRAPHIE DE L’HYDROGENE Dr. A. BELHACHEM Maitre-Assistant en Chimie Minérale Pharmaceutique I. INTRODUCTION L’atome d’hydrogène, le plus simple de tous, est le constituant essentiel de l’univers, son intérêt théorique se double pour le dihydrogène. C’est le premier élément de la classification périodique, n’appartient en réalité à aucun groupe, il est mis arbitrairement dans le groupe I (1s1). Par certaines de ces propriétés il se rapproche des métaux .il est assez bon conducteur de chaleur. Comme les métaux l’hydrogène donne un ion positif H+. D’autres parts il possède quelque caractère des halogènes du groupe XVII, il donne comme eux des molécules diatomiques. Il peut donner un ion négatif, en effet les hydrures métalliques sont comparables aux sels des halogènes. II. HISTORIQUE ET ORIGINE Le nom hydrogène est composé du préfixe « hydro », signifiant « eau », et du suffixe « gène » : « engendrer ». Ce nom a été inventé par Lavoisier pour désigner le gaz appelé à l'époque « air inflammable » et qui avait été mis en évidence par Cavendish en 1766. Il s'agit du gaz de formule chimique H2 L'hydrogène est l'élément le plus abondant de l'Univers (75 % en masse), le principal constituant du Soleil et de la plupart des étoiles, dont l'énergie provient de réactions de sa fusion thermonucléaire (qui combinent 4 noyaux d'atomes d'hydrogène (4 protons) pour former un noyau d'atome d'hélium III. ETAT NATUREL : Dans la croûte terrestre, l'hydrogène ne représente que 0,22 % des atomes. Il provient de : • Gaz naturels ; gaz des volcans, • Des gisements pétrolifères, • Et en très petites quantités sous forme d’inclusions gazeuses dans certains minerais et roches. • Il est très abondant sous forme liée, telles que : l’eau, et les combinaisons hydrogénés du carbone fossilisées ➢ L’hydrogène peut donc être sous forme de : a) Hydrogène Moléculaire : « le Dihydrogène » L’élément hydrogène donne un seul corps pur simple le dihydrogène H2, à spins antiparallèles. L’hydrogène moléculaire est donc un mélange d’ortho dihydrogène (OH2) Et de para dihydrogène (PH2). Ces formes Ortho et Para, ont des énergies internes différentes ; La forme para possède une énergie plus faible. Elles manifestent donc des différences importantes dans leurs propriétés physiques (Pt d’ébullition, Chaleurs Spécifiques, conductivité thermique) Fig 01 : Les deux formes d’hydrogène moléculaire : b) Hydrogène Atomique : Dans les conditions convenables de Température et de Pression, les molécules H2 se dissocient en atomes : H2↔ 2H - ∆H La réaction de dissociation est très endothermique L’hydrogène atomique est chimiquement plus actif que l’hydrogène moléculaire, ainsi : À Température normale l’hydrogénation du Soufre, Phosphore, Arsenic et Antimoine est très aisée. On peut avoir formation d’hydrures alcalins de type LiH, NaH. IV. LA PREPARATION : 1. Préparation Industrielle : a. A partir des gaz de houille ou de fours à coke : La pyrogénation de la houille entraîne la production de gaz. La séparation de l'hydrogène est réalisée par distillation fractionnée vers (-190 °C). Un traitement préalable élimine les gaz soufrés et le gaz carbonique. Ce dernier est facilement dissous dans de l'eau sous pression. On peut obtenir suivant la qualité de la houille de 10 à 25 kg d'hydrogène par tonne de charbon. b. A partir de l’eau : La décomposition de l’eau en présence de réducteur produit de l’hydrogène, on distingue : i. Réduction chimique de la vapeur d’eau : ➢ Réduction par le fer : Le fer réduit la vapeur d'eau au rouge : ➢ Réduction par le carbone : La réduction de la vapeur d'eau par le carbone au rouge (coke), donne le «gaz à l'eau» : ➢ Réduction par le phosphore. Le phosphore réduit la vapeur d'eau à 500 °C environ en présence de catalyseur, avec formation d'hydrogène. ii. Réduction Electrolytique : L'eau pure conduit à peine le courant électrique, mais l'addition d'acides ou de bases permet l'électrolyse. Les acides ont l'inconvénient d'être corrosifs, aussi utilise-t-on surtout les alcalis comme la potasse et la soude. Les électrodes peuvent alors être en métal peu coûteux, comme le fer inattaqué par l'alcali. Fig 02 : Electrolyse de l’eau 2. Préparation au laboratoire : Préparation par action d’un acide sur un métal : L’hydrogène est préparé en laboratoire par action des acides sur les métaux. L’acide sulfurique est alors ajouté au zinc granulé. Du sulfate de zinc est formé et de l’hydrogène est libéré selon la réaction suivante : Fig 03 : Montage de préparation de l’hydrogène en laboratoire V. PROPRIETES PHYSIQUES : Le dihydrogène est dans les conditions usuelles un gaz incolore, inodore et insipide. La très faible masse de la molécule H2, la plus petite connue, il en résulte : une faible densité pour l’hydrogène (l’air est 14,5 fois plus dense). Il a une grande facilité de diffusion (à travers les parois) et d’effusion (à travers les pores) L'hydrogène est le plus inflammable de toutes les substances connues. Les Isotopes : L’élément hydrogène est un mélange de trois nucléides : Fig 04 : Les 03 isotopes de l’hydrogène Tableau 01 : Propriétés Physiques des isotopes d’hydrogène a) L’hydrogène léger ou protium (1H) : c'est le plus abondant (~99,98 %). Simplement constitué d'un proton et ne possédant donc pas de neutron, c'est un isotope stable. b) Le deutérium (2H ou D) : beaucoup moins abondant, il possède un proton et un neutron et c'est un isotope stable. Présent essentiellement (sur Terre) sous forme d'oxyde de deutérium ou eau lourde qui est obtenu par technique de fractionnement de l’eau, par distillation ou par électrolyse. c) Le tritium (3H ou T) ; Constitué d’un proton et de deux neutrons, il n'est présent qu'en infime quantité. Instable, c'est le seul isotope radioactif de l’hydrogène. La configuration électronique, les propriétés chimiques sont essentiellement les mêmes, mais la différence de masse considérable entraine des différences des propriétés physiques plus grande. Dans l’environnement, le tritium peut prendre la place de l’hydrogène dans toutes les molécules où il est présent, y compris dans les molécules « biologiques » et jusque dans l'ADN où il peut être cause de cassure de l'ADN, de mutations ou d'apoptoses cellulaires. VI. PROPRIETES CHIMIQUES Stabilité ionique : L’hydrogène peut acquérir une configuration ionique stable de deux façons : ➢ En fixant un électron pour donner H-, cette affinité électronique se manifeste dans les combinaisons avec les métaux les plus électropositifs (alcalins et alcalino-terreux) : elle traduit le caractère électronégatif et oxydant de l’hydrogène. ➢ En perdant son unique électron pour donner le proton H+, il joue le rôle d’élément électropositif ce qui l’apparente aux métaux, son électropositivité se manifeste particulièrement dans son action sur les éléments les plus électronégatifs. Il fonctionne alors comme un réducteur. 1. Action sur les non métaux : Les halogènes : Le fluor se combine énergiquement à l’hydrogène à température ambiante : Avec le chlore la combinaison se fait au-delà de 400 °C. La lumière provoque l’explosion mélange. Avec le brome et surtout avec l'iode, la combinaison directe est plus difficile. Il faut chauffer : L'oxygène : La réaction ne se fait pas à froid. Une élévation de température, un catalyseur (mousse de platine) provoquent l'explosion du mélange. On aura dégagement de chaleur 2. Autres non métaux : L'hydrogène réagit avec les métalloïdes de la famille de l’oxygène ; soufre, sélénium, tellure, mais plus difficilement qu'avec l'oxygène. L’azote se combine dans des conditions particulières (synthèse de l'ammoniac). Le carbone se lie difficilement à l'hydrogène. Propriétés réductrices de l’hydrogène : ➢ Oxydes métalliques : L'hydrogène s'empare de l'oxygène en donnant, soit un oxyde moins oxygéné, soit le métal lui-même. Il y a formation d'eau. ✓ L’oxyde d'argent Ag2O est réduit à froid. ✓ Un grand nombre d'oxydes sont facilement réduits à chaud, tels ceux du cuivre, plomb, fer, nickel, cobalt. On obtient le métal : L'hydrogène ne peut cependant réduire tous les oxydes car certains métaux sont plus réducteurs que lui. ➢ Sels : Les chlorures et les sulfures sont réduits à l'état métallique avec formation d'acide chlorhydrique ou d'hydrogène sulfuré : VII. ETUDE DES HYDRURES Trois classes de composés très différents peuvent se former. Leur nature est liée à la position de l’élément considéré dans le tableau périodique (Electronégativité). 1. Les Hydrures ioniques ou salins : ✓ Correspondant aux éléments les plus électropositifs c'est-à-dire tous les éléments du bloc s sauf Be polymérique et Mg qui donne MgH2 covalent ✓ De formule MH avec les alcalins et MH2 avec les alcalinoterreux, les hydrures ioniques ou salins sont caractérisés par l’ion H-. Leur préparation se fait par chauffage du métal dans H2 2. Les Hydrures interstitiels ou métalliques : ✓ Les hydrures interstitiels se forment avec les éléments de transition du bloc d ainsi qu’avec le Béryllium et le uploads/s3/ hydrogene.pdf
Documents similaires









-
61
-
0
-
0
Licence et utilisation
Gratuit pour un usage personnel Attribution requise- Détails
- Publié le Sep 03, 2022
- Catégorie Creative Arts / Ar...
- Langue French
- Taille du fichier 0.6159MB


